REVISIÓN
FÍSTULA PERIANAL: ¿CÓMO LO HAGO?
C.C. González-Gómez1, J. Trébol López2, N. González Alcolea1, F. Tone Villanueva1, J. Saavedra Ambrosy1, J.L. Marijuan Martin3
1-Servicio de Cirugía General y del Aparato Digestivo. Hospital Universitario La Paz, Madrid, España. 2- Servicio de Cirugía General y del Aparato Digestivo. Complejo Asistencial Universitario de Salamanca, España. 3- Jefe de Sección de Cirugía Colorrectal; Hospital Universitario La Paz, Madrid, España
Correspondencia: para contactar con la autora accionar aquí (Carolina González).
Rev Acircal. 2019; 6 (2): 21-49.
Palabras clave: Fístula perianal. Fístula rectal. Fistulotomía. Fistulectomía. Flap. Setón. LIFT. VAAFT. Terapia celular.
Descargar artículo en PDF
Introducción:
Las fístulas perianales son trayectos epitelizados entre el canal ano-rectal y el tejido perianal, o entre recto y vagina en el caso de las fístulas rectovaginales.
En la mayor parte de los pacientes se considera que poseen un origen criptoglandular, como una manifestación tardía de una sepsis perirrectal, tras la infección de las glándulas anales, apareciendo como secuela tras un absceso perianal (entre el 15-40% de ellos) aunque también pueden aparecer sin absceso franco previo. No está claro qué abscesos evolucionan a una fistula; como factores de riesgo suelen describirse la enfermedad inflamatoria, el sexo femenino, tener menos de 60 años y las localizaciones interesfinteriana o isquiorrectal frente al perianal propiamente dicho. Excepcionalmente serán secundarias a otros procesos como enfermedad inflamatoria intestinal, infecciones (tuberculosis, actinomicosis, linfogranuloma venéreo), cuerpos extraños, tumores, enfermedad inflamatoria pélvica, traumatismos y radiación.
Su incidencia se estima en torno a 1-2.8 de cada 10.000 habitantes por año en la Unión Europea[1], siendo su prevalencia más frecuente en varones que en mujeres, con un pico máximo entre los 20 y los 30 años.
Los métodos diagnósticos esenciales son la exploración física (que puede ser válida de forma aislada, sin pruebas complementarias, en los casos simples si se caracteriza de forma completa la fístula) y las exploraciones complementarias para caracterizar la anatomía fistulosa (ecografía endoanal y RMN principalmente), para valorar la funcionalidad y anatomía esfinteriana (manometría, ecografía y/o resonancia) y para despistar enfermedades subyacentes (endoscopias), que deben emplearse de forma juiciosa, selectiva y protocolizada. La ECO y la RMN además informan de la presencia de abscesos o cavidades inflamatorias asociadas, así como de trayectos secundarios.
Hoy en día se considera que la curación espontánea o medicamentosa es tan improbable que el tratamiento definitivo es principalmente quirúrgico, si bien los resultados obtenidos con las múltiples técnicas descritas resultan en ocasiones desalentadores, pues con cierta frecuencia se precisan varias intervenciones para lograr el cierre completo del trayecto fistuloso.
En toda intervención quirúrgica de estos pacientes los objetivos buscados son lograr el cierre completo y duradero (sin recidivas), evitando un daño del aparato esfinteriano y previniendo la formación de abscesos garantizando a la vez la mejor calidad de vida. En cada paciente deberemos individualizar el mejor momento para dicha intervención quirúrgica, así como la técnica a aplicar; dado que, si en el momento de la cirugía el paciente presenta mal control de la enfermedad de base o de la infección regional, las posibilidades de conseguir un cierre fistuloso completo y permanente disminuyen considerablemente. Es decir, en los casos secundarios a una patología, el tratamiento quirúrgico debe acompañarse por tanto de una correcta terapia médica y si hay una intensa afectación inflamatoria regional con abscesos mal drenados puede ser más juicioso un procedimiento escalonado empezando por procedimientos de limpieza como drenajes, curetajes, setones laxos y dejar para un momento más apropiado el procedimiento a priori más resolutivo o definitivo.
Material y métodos:
Realizamos una descripción de las principales técnicas quirúrgicas y sus resultados, así como una revisión narrativa de las principales publicaciones científicas, consultando las bases de datos Medline y The Cochrane Library Plus, sin restricción de fecha, en español e inglés, sin limitaciones respecto al tipo de estudio. Se revisaron los abstracts y, en los casos necesarios, los artículos completos; seleccionando finalmente todos los artículos que incluían recomendaciones terapéuticas respecto al manejo quirúrgico de la fistula perianal.
Clasificación de las fístulas:
Pretende reflejar su disposición anatómica y con ello busca permitir individualizar el tratamiento, informar sobre el pronóstico y posibles complicaciones y evaluar los resultados. Hay dos grandes clasificaciones:
-
- Morfológica, basada en la relación del trayecto con el complejo esfinteriano (clasificación de Parks).
Desarrollada en 1976 por Parks, Gordon y Hardcastle, la más empleada actualmente[2]. Se basa en la teoría criptoglandular y en la situación del trayecto en relación con la musculatura esfinteriana; distingue cuatro grupos, cada uno subdividido según la prolongación de sus extensiones o ramificaciones.
- Interesfinterianas (35%-70%): su trayecto principal está en dicho espacio (ver número 3 figura 1). Puede presentar cuatro subtipos:
- Con trayecto simple. El más frecuente. Habitualmente se describe como fístula baja.
- Con trayecto alto ciego. Extensión entre el esfínter interno y el músculo longitudinal del canal anal superior.
- Interesfinteriana alta. Como la anterior cuando se abre al recto inferior (frecuentemente de forma yatrógena durante la exploración).
- Con extensión pélvica. Alcanza el espacio supraelevador. Si la drenamos a través de la fosa isquiorrectal provocaríamos una fístula supraesfinteriana con total seguridad.
- Transesfinterianas (20%-48%): atraviesan el esfínter externo (ver número 2 figura 1). Se subclasifican en:
- No complicadas: el trayecto, desde el plano interesfinteriano atraviesa el esfínter externo (a una altura variable), y desde la fosa isquiorrectal se abre a la piel.
- Con trayecto alto ciego. Se extiende además cranealmente hacia el ápice de la fosa isquiorrectal pudiendo alcanzar el espacio pélvico atravesando el elevador.
- Supraesfinterianas (3%-15%): Son resultado de un absceso supraelevador. Comienza en el espacio interesfinteriano y continúa por él hasta rodear al puborrectal para descender entre él y el resto del elevador del ano, entrando en la fosa isquiorrectal hasta la piel perineal; abraza así enteramente la masa esfinteriana (ver número 4 figura 1).
- Extraesfinteriana (2%-6%): Se extiende desde la piel perineal por la fosa isquiorrectal, atraviesa el elevador del ano y penetra en la luz rectal (ver número 1 figura 1). Hay tres tipos patogénicos:
- Secundaria a una fístula trans o supraesfinteriana. De forma espontánea o más frecuentemente por yatrogenia.
- Secundaria a cuerpo extraño o traumatismo.
- Por enfermedad específica.
- Subcutáneo-mucosa o superficial: No sigue la etiología criptoglandular. Generalmente secundaria a una fisura anal infectada o a intervenciones como la esfinterotomía interna o la hemorroidectomía.
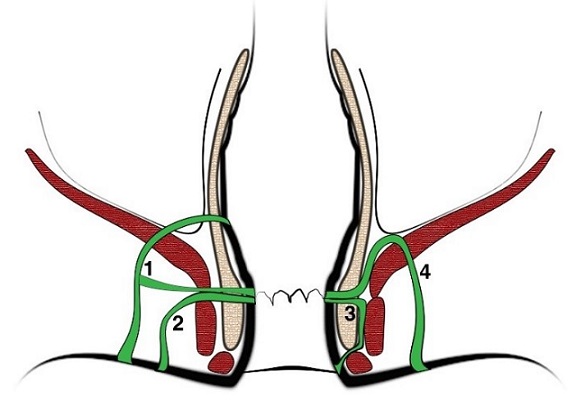
Figura 1: clasificación morfológica de las fístulas.
-
- Terapéutica, basada en la dificultad y los resultados del tratamiento: fístulas “simples” y fístulas “complejas”.
Es muy controvertida, pero está avalada por las principales sociedades científicas como la ASCRS (American Society of Colorectal Surgery).
Para la mayoría de los autores son complejas aquellas cuya curación requiera una excesiva división del aparato esfinteriano que conlleva un potencial compromiso de la continencia.
Las simples (en torno al 70% del global) son aquellas con orificios interno y externo fáciles de identificar y con trayectos únicos, rectilíneos, bajos y que atraviesan poco o nada de esfínter externo (es decir: superficiales, interesfinterianas y transesfinterianas bajas).
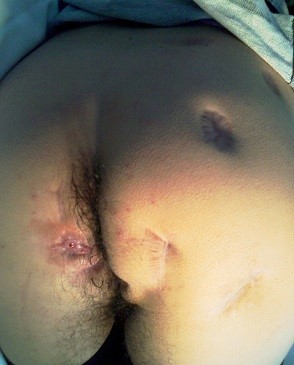
Serían complejas, en grado ascendente, las transesfinterianas que atraviesan el tercio superior del esfínter externo, las supraesfinterianas y las extraesfinterianas. Otros autores incluyen también las asociadas a condiciones especiales (radioterapia, Crohn, recidivadas, pacientes con alto riesgo de incontinencia,…), fístulas singulares (rectovaginales) o las complejas anatómicamente (sin orificio interno, orificio interno por encima de la línea pectínea, con múltiples orificios internos y/o externos, con múltiples trayectos y/o cavidades interpuestas, trayecto paralelos al recto, trayectos no palpables bajo la piel) incluidas las anteriores en la mujer (ver imagen 1).
 |
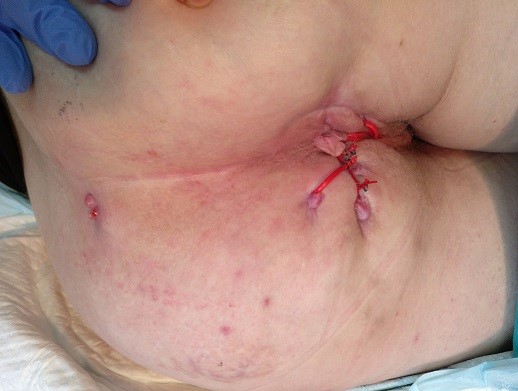 |
Imagen 1: fístulas complejas en pacientes con Enfermedad de Crohn. En la imagen de la izquierda se aprecia un solo orificio activo perianal izquierdo y múltiples orificios de drenajes previos incluso glúteos. En la de la derecha varias fístulas tutorizadas con setones laxos y un orificio casi en el sacro que comunicaba con los setones ipsilaterales.
Maniobras exploratorias para caracterización de las fístulas:
El objetivo fundamental en la consulta es caracterizar lo máximo posible la anatomía de la fístula y orientar hacia si será compleja o simple mediante la exploración física y el uso selectivo de las pruebas complementarias. Posteriormente en el quirófano debe hacerse una exploración lo más rigurosa posible. De hecho, aún hoy (en disputa con la RMN) se sigue considerando la exploración bajo anestesia como el gold standard en la caracterización y descripción de la fístula.
Maniobras en consulta:
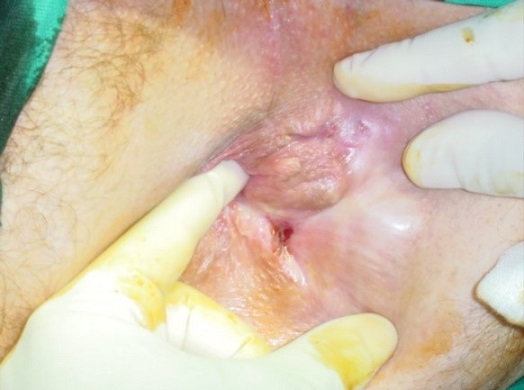
La inspección de la región perianal debe buscar el orificio externo (una sobreelevación de tejido de granulación con descarga de pus –ver imagen 2-) que en ocasiones es pequeño y sólo podremos descubrirlo haciendo presión. Su situación puede orientarnos hacia el tipo de fístula: las interesfinterianas lo tendrán muy cerca del margen anal y las transesfinterianas más lejos; cuando está muy distante es más probable un trayecto ascendente.
 |
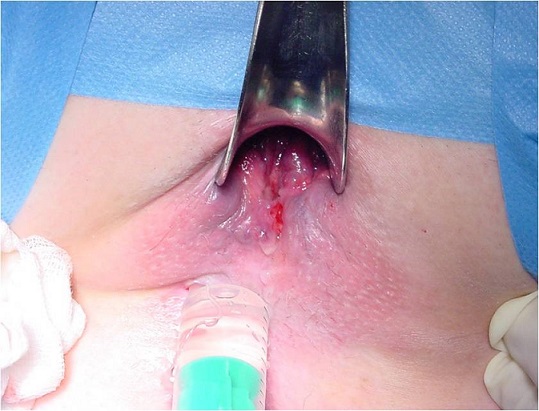 |
Imagen 2 (izq): visualización de orificios externos. Imagen 3 (dcha): anuscopia instilando agua oxigenada para localizar orificio interno.
La palpación tiene como objetivo apreciar el cordón de induración producido por el trayecto. Uno bajo puede apreciarse como una estructura radial hacia el ano, mientras que uno alto suele perderse en la masa muscular.
La posición del orificio interno puede sospecharse por la del orificio externo, según la regla de Goodsall (aunque tiene un valor predictivo limitado); así como por la dirección del trayecto fistuloso a la palpación. Según Goodsall, se traza una línea transversal por el medio del ano y el periné; si el orificio externo está posterior a ella el interno estará en la línea media posterior; si es anterior, se dirige radialmente a la cripta más próxima. La regla es más válida para los orificios posteriores; en el caso de los anteriores, Cirocco y Reilly encontraron que 71% se dirigen a la línea media anterior, especialmente en las mujeres, en las que la dirección radial se cumple solo en 31%[3]. Según otros estudios, se cumple entre el 50 y el 80% de los casos[4]. El tacto rectal podrá palpar el orificio interno como un nódulo indurado o como una pequeña depresión; otra forma de detectarlo es comprimiendo hacia el ano el tracto fibroso para notar como protruye; es el signo de la “herniación” o “funnel”. El tacto es útil para valorar la actividad esfinteriana y detectar pacientes con riesgo de incontinencia.
La posición del orificio interno deberá ser visualizada idealmente mediante anuscopia (ver imagen 3), lo cual nos permitirá, además, descartar cualquier otra patología concomitante. No siempre es factible su realización en una consulta y sin apoyo de sedación/analgesia. Igualmente, la instilación de sustancias “marcadoras” o el empleo de sondas metálicas maleables, aunque puede realizarse por proctólogos experimentados, suele reservarse para la exploración en el quirófano, como comentaremos después.
Maniobras en quirófano:
Tras localizar el orificio fistuloso externo y valorar su permeabilidad, procederemos a la caracterización del orificio fistuloso interno y el trayecto.
En aquellos casos que plantean dificultad en la identificación del orificio fistuloso interno, se pueden instilar sustancias “marcadoras” colorantes o no (azul de metileno, agua oxigenada diluida, leche o suero salino) por el orificio fistuloso externo y buscando a nivel de la línea dentada con la orientación comentada de la regla de Goodsal. En algunos trabajos de la literatura se describe la instilación de leche en la identificación del orificio interno[2]. Algunos autores describen casos de neumorretoperitoneos[5] e incluso de embolia gaseosa[6] tras el uso de agua oxigenada, por lo que debe evitarse su instilación a presión y su uso sin diluir empleando soluciones de máximo al 3%. Nuestro grupo prefiere la instilación de suero salino fisiológico para la identificación del orificio fistuloso interno.
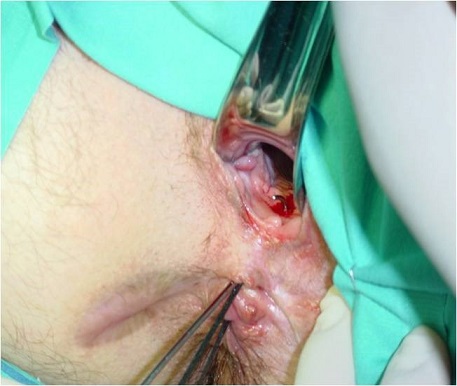
El empleo de sondas metálicas maleables (como un estilete, la sonda de Lockhart Mummery o sondas con ojales para pasar sedales o setones) puede ayudarnos a localizar el orificio interno (hasta en dos tercios de los pacientes) y a orientarnos sobre el tipo de fístula (ver imágenes 4 y 5). Idealmente, debería tutorizarse desde el orificio interno hacia el externo para minimizar el riesgo de crear nuevos orificios internos, pero esto a veces es muy laborioso sobre todo si no se ha conseguido objetivar el orificio interno por los otros métodos.
 |
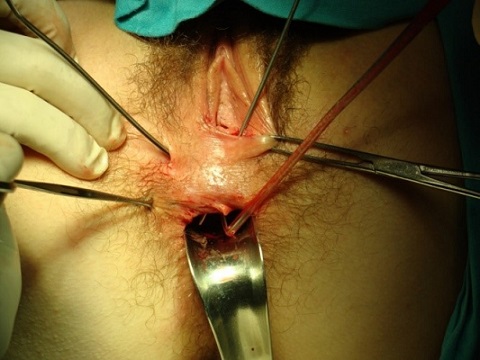 |
Imágenes 4 y 5: tutorización de trayectos fistulosos con sondas metálicas. A la izquierda fístula rectovaginal. A la derecha fístula compleja en paciente con Crohn con un único orificio interno del que salen tres trayectos, dos perianales anteriores y otro rectovaginal.
La sonda debe mantenerse con una mano dentro del trayecto mientras que el dedo índice de la otra mano, introducido en el canal anal, puede tocar su punta en el orificio interno y establecer la relación del trayecto con el canal anal y la musculatura esfinteriana. Es fundamental ser extremadamente delicado en estas maniobras para evitar producir falsas vías o trayectos. Muchos autores recomiendan realizar estas maniobras exclusivamente en el quirófano. Si el ángulo de paso es mayor de 80º, es muy probable que haya un trayecto ascendente y una fístula alta (supraelevadora, etc.); si es de unos 30º es probablemente baja y simple.
Otras maniobras que pueden ayudar a identificar el orificio interno son:
- Seguir el tejido de granulación de la fístula hasta el origen de la misma.
- Traccionar del tracto tras su disección parcial en el tejido subcutáneo hacia el aparato esfinteriano y notar cómo se tira de la cripta anal correspondiente.
En función de las características de la fístula, la presencia de abscesos o sepsis, la continencia y las comorbilidades del paciente, realizaremos unas técnicas u otras.
Principales técnicas quirúrgicas:
Desde un punto de vista docente podríamos considerar tratamientos complementarios cuya finalidad es el control de la sepsis local (incluye el drenaje de colecciones, desbridamientos, curetajes, etc.) y específicos que buscan:
- Tutorizar parte o la totalidad del trayecto: seton laxo.
- Obturar el tracto sin extirpar o extirpando escaso tejido. Podrían incluirse en este apartado las novedosas técnicas mínimamente invasivas basadas en láser y/o terapias fotodinámicas.
- Exéresis parcial: incluye el sedal cortante, la fistulotomía y el curetaje o legrado y las variantes limitadas de las siguientes.
- Exéresis total o subtotal: busca extirpar todo el tejido inflamado (incluyendo la glándula origen del proceso): fistulectomía y core-out.
- Ocluir el orificio interno para eliminar la comunicación con el canal anal.
- Desconectar partes del trayecto fistuloso: LIFT.
Estas técnicas pueden combinarse entre sí (por ejemplo: un core-out o fistulectomía hasta el aparato esfinteriano y una oclusión del orificio interno con un colgajo de avance, el curetaje no suele emplearse de forma aislada, etc.).
Setones:
Existen dos tipos de setones: cortantes y laxos[7].
Su uso es probable que comenzara en los tiempos de Hammurabi (1750 a.C.), pero está perfectamente documentado ya en el antiguo Egipto (1250 a.C.) y en tiempos de Hipócrates (400 a.C.)[8],[9].
Los setones laxos suelen realizarse con materiales muy inertes y livianos, como pueden ser un vessel-loop o drenajes tipo silastic; permiten mantener la fístula permeable (función de “drenaje”) con el fin de evitar el acúmulo de secreciones con su posterior sobreinfección, disminuir la formación de abscesos evitando cierres en falso y definir el tracto (ver imagen 6). En este caso el sedal o seton va por dentro del tracto pero no está anudado fuertemente para “seccionar” el tejido. Ocasionalmente se produce una cura “espontánea” del proceso. Puede retirarse a pie de cama o en quirófano; en fístulas complejas permite una cirugía en un segundo tiempo, generalmente será un tratamiento “puente”.

Imagen 6: paciente con múltiples fístulas perianales secundarias a enfermedad de Crohn y setones laxos tutorizando los diferentes trayectos.
Respecto a los setones cortantes son aquellos que se colocan fuertemente anudados atravesando el esfínter anal externo. La mayoría son de nylon o de seda, materiales que generan más respuesta inflamatoria. Frecuentemente se van a colocar tras retirar la piel y el celular subcutáneo que están sobre el esfínter externo, directamente en contacto con el músculo. Pueden emplearse en fístulas transesfintéricas que afectan a más del 30% del complejo esfinteriano. Pueden asociarse a una fistulotomía y fistulectomía parcial del tracto y se reajustan a pie de cama cada 7-14 días[10]. En estas formas intermedias de uso, se puede poner el seton solo alrededor del esfínter externo y extirpar el interno como si fuera una “fistulotomía”; parece ser que esta sección del interno supone una mayor incontinencia y actualmente se tiende más a su preservación[11]. En otras ocasiones se hace fistulectomía hasta el esfínter externo y se deja el seton ajustándolo, pero sin tensarlo y va progresivamente “cayendo” hacia el margen anal haciendo la sección sin dolor. Incluso en otras formas con sedal se va frotando con él para hacer pasar el nudo por el interior del trayecto varias veces al día para generar la respuesta inflamatoria progresivamente[12].
La sección lenta del trayecto fistuloso produce una fibrosis progresiva del mismo, con el fin de intentar evitar la incontinencia en pacientes en los que la fistulotomía dañaría más del 30-50% del esfínter anal. La tasa de incontinencia se sitúa en torno al 15-25%, que algunos autores consideran inaceptable, y las tasas de curación se encuentran incluso por encima del 90%[7],[13],[14],[15]. El tiempo de permanencia del seton es muy variable según los autores, pero en general debe superar las 4-6 semanas para que se produzca una cicatrización satisfactoria[10]. Como inconvenientes de estas técnicas, el tiempo de permanencia del seton es largo, pueden asociar bastante dolor y el manchado es continuo. Vemos, por tanto, que existe una gran heterogeneidad en la indicación, la colocación y el manejo de estos setones “cortantes” que imposibilitan obtener conclusiones claras acerca de los mismos. Aunque criticado por muchos autores, la realidad es que en la práctica se usa bastante más de lo que parece y hay trabajos que reportan resultados más que razonables de curación con incontinencias menos frecuentes de lo “esperable”[16]; pero en principio no se recomienda su uso sistemático y las principales guías recomiendan un uso muy selectivo y previa información rigurosa al paciente acerca del potencial riesgo de incontinencia[17].
Para concluir, respecto del manejo de los setones, la bibliografía es amplia y muy variada en cuanto a su naturaleza y forma de uso, por lo que es muy difícil extraer conclusiones globales al respecto de su eficacia; esperemos que se vaya aclarando o concretando en los próximos años.
Curetaje o legrado:
No se aplica de forma aislada sino asociada a otros procedimientos (flaps obturaciones, etc). Consiste en el refrescamiento o desbridamiento con legras, curetas o cucharillas, etc., del tracto buscando reavivar el tejido de granulación y eliminar los restos de tejido epitelial que participan en perpetuar la fístula (ver imagen 7).
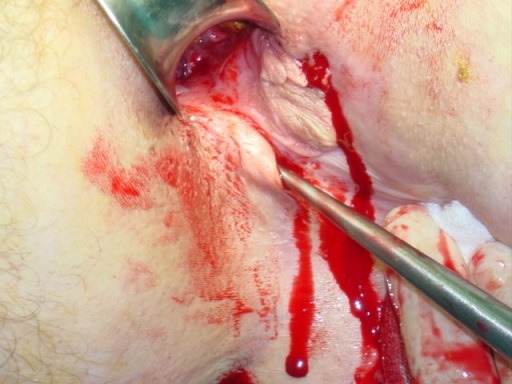
Imagen 7: curetaje o legrado, complemento de otras técnicas en la fístula perianal.
Fistulotomía:
La fistulotomía o puesta a plano del trayecto fistuloso es el tratamiento más aceptado para aquellas fístulas de localización baja (que involucran menos de un tercio del esfínter anal externo), simples (trayecto único, no recurrentes, descritas como submucosas, interesfintéricas o transesfintéricas bajas y no anteriores en la mujer) y cuando la continencia es perfecta. Generalmente se evita en pacientes con Enfermedad de Crohn. Se han propuesto diferentes escalas o scores para seleccionar candidatos idóneos para este tipo de técnica[18].
Tras la exploración bajo anestesia e identificación del orificio externo e interno, tutorizaremos el trayecto con una sonda, y posteriormente realizaremos una sección del tejido que se encuentra sobre la sonda (ver imágenes 8 y 9).
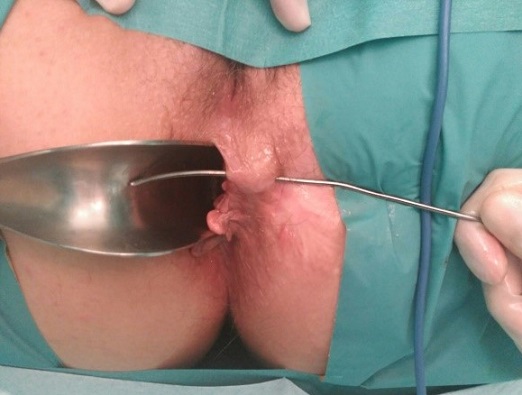 |
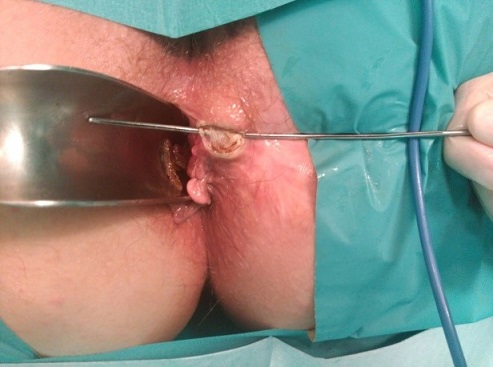 |
Imágenes 8 y 9: fistulotomía y puesta a plano de fistula perianal simple.
El lecho fistuloso se debe cauterizar o refrescar con una legra con el fin de eliminar los restos de material necrótico, y en aquellas fístulas de evolución tórpida deben tomarse muestras con el fin de descartar malignidad. La marsupialización del lecho quirúrgico acorta el tiempo de cicatrización, si bien no está universalmente extendida[7],[10].
En pacientes con fístulas complejas puede realizarse, como se ha comentado con anterioridad, una fistulotomía parcial del trayecto, desde el orificio externo hasta el esfínter anal, colocando un setón más o menos cortante en el trayecto restante[14],[19] o incluso de la parte interna del trayecto (por dentro del esfínter externo). En fístulas complejas, si se hiciera una fistulotomía completa, debe acompañarse de una reparación esfinteriana (frecuentemente con solapamiento de bordes) ya que si no se realizara el riesgo de incontinencia sería a todas luces inasumible.
La tasa de curación se sitúa en torno al 90-100%, y la incontinencia secundaria a esta técnica presenta una incidencia de entre el 0 y el 40% en las diferentes series [10],[19],[20]. Es la técnica más sencilla, más frecuentemente empleada y con mejores resultados a largo plazo si está correctamente indicada; sin embargo, la evitaremos en pacientes con fístulas perianales altas, trayectos múltiples o enfermedad de Crohn.
Fistulectomía:
La fistulectomía o escisión del trayecto fistuloso puede emplearse para fístulas simples o complejas. Deben extirparse los orificios interno y externo y el trayecto fistuloso en bloque con un margen de tejido sano (incluyendo también piel y subcutáneo), pero en la práctica, en fístulas complejas, debe hacerse respetando el aparato esfintérico o proceder a su reparación extirpando la menor cantidad posible. El defecto del orificio interno puede cerrarse mediante una sutura simple, si bien se recomienda mantener abierto el defecto externo a modo de drenaje.
Las indicaciones son superponibles a las de la fistulotomía, pero asocia una mayor morbilidad, y precisa de cirujanos colorrectales experimentados que puedan realizar reparaciones esfinterianas si se precisan. En casos de fistulas altas puede realizarse una fistulectomía parcial del trayecto hasta el complejo esfinteriano y asociarla con la colocación de un setón[10].
En general tiene menos uso que la fistulotomía por asociar tasas de incontinencia mayores y un tiempo de cicatrización mayor[10].
El core-out es una variante que consiste en extirpar todo el tejido fistuloso y de forma limitada parte del tejido circundante, sin llegar hasta la piel. Se crea un “túnel” de mayor diámetro que el de la fístula haciendo una resección esfinteriana lo más limitada posible que se reconstruirá. Igualmente, puede usarse en combinación con setones y colgajos de avance como la anterior.
Colgajos de avance:
Los colgajos de avance son técnicas para ocluir el orificio interno que se reservan para pacientes con fístulas complejas, altas (transesfinterianas altas, supraesfinterianas, etc.), en pacientes con deterioro o factores de riesgo de incontinencia o con fístulas recidivadas, y que precisan un cirujano colorrectal experimentado para su elaboración.
Existen ciertas controversias en torno a su confección, como el tipo de colgajo según el espesor (completo o parcial), el tipo de cierre del orificio interno y cómo tratar el trayecto (fistulectomía, curetaje u obturaciones con fibrina). Los colgajos mucosos o rectales deben ser para muchos autores idealmente completos (incluyendo mucosa, submucosa y muscular) y su tallado debe ser meticuloso, realizando una hemostasia exquisita con el fin de evitar la posterior formación de hematomas y abscesos. Esta técnica no está recomendada en pacientes con infección activa por la alta tasa de fracaso ni en pacientes con estenosis rectales. En estos pacientes colocaremos un setón laxo como terapia puente.
El colgajo más comúnmente empleado es el rectal. Tras la localización de los orificios rectal y perianal se canaliza el trayecto fistuloso y se legra. El colgajo se realizará con morfología de “U”, con una base (parte más alta o interna) más ancha que permita una correcta vascularización de la parte más distal. Se pueden comenzar desde el surco interesfinteriano o desde la unión anocutánea y deben superar al menos 3-4cm el orificio interno. El orificio rectal se extirpa, el inicio del tracto se cierra con una sutura reabsorbible de 2/0 o 3/0 y el colgajo debe cubrir ampliamente la zona del orificio fistuloso rectal y acabar donde se inició. Su espesor abarcará la mucosa, submucosa y parcialmente el esfínter anal interno. Se sutura con puntos interrumpidos para disminuir el riesgo de dehiscencias, pudiendo utilizarse sutura monofilamento o trenzada, preferiblemente de materiales reabsorbibles (ver imágenes 10-13) siendo muy útiles las agujas de arco amplio (por ejemplo de 5/8). En pacientes seleccionados puede realizarse un colgajo de espesor parcial, si bien los resultados parecen ser menos satisfactorios, frente a uno de espesor completo[10],[15], en lo que se refiere a la recurrencia, aunque podrían mejorar la incontinencia a gases. En las fístulas rectovaginales puede combinarse el colgajo de avance rectal con uno vaginal para ocluir ambos extremos del trayecto fistuloso.
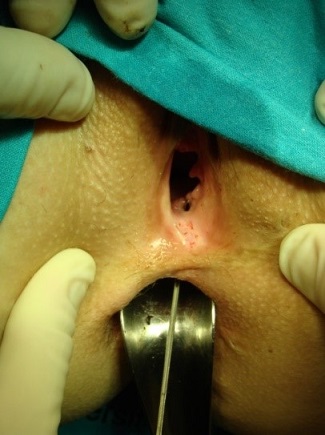 |
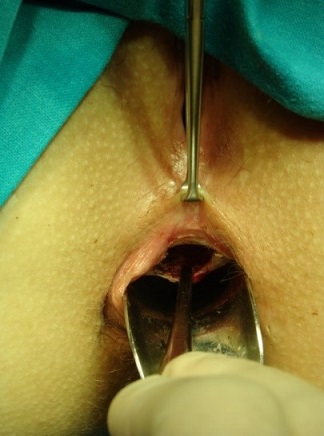 |
Imágenes 10-11: elaboración de colgajo rectal en paciente con fístula rectovaginal.
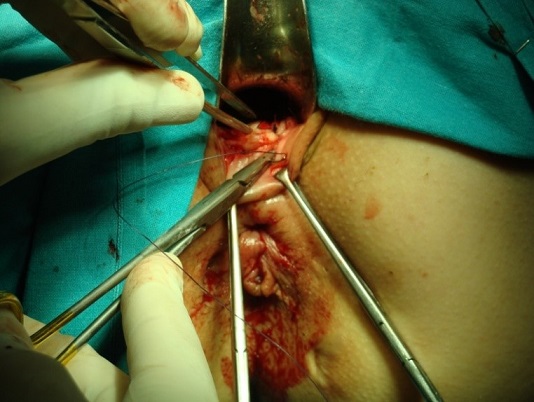 |
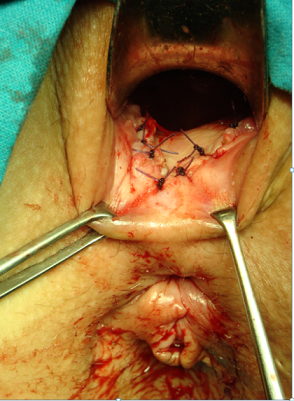 |
Imágenes 12-13: elaboración de colgajo vaginal en paciente con fístula rectovaginal.
La tasa de éxito varía entre el 29 y el 90% de los casos, en función de las series[10][21]; esta amplia discrepancia se debe tanto a las diferencias técnicas como a la selección de los pacientes. En cuanto a la continencia postoperatoria, es un problema difícil de extraer conclusiones de la literatura por la variabilidad en sus formas y medidas y un probable problema de escaso reporte de sus alteraciones. Por un lado, existen publicaciones que reflejan que pueden existir problemas de continencia antes de la cirugía en 8.9-14.2% de los pacientes[22]. Por otro lado, se conocen alteraciones manométricas[23] y tasas de alteración de la continencia del 0-35% postoperatorias, dependiendo de cómo se mida y de la preservación o no del esfínter interno[24].
Las complicaciones más frecuentes son la formación de hematomas, abscesos o la dehiscencia de la sutura. También existen otras menos frecuentes como fiebre, dolor o infección urinaria. La principal contraindicación de esta técnica es la presencia de proctitis o absceso en el momento de la cirugía[21]. La presencia de enfermedad de Crohn o el hábito tabáquico se correlacionan significativamente con su fracaso[10]. Parece ser que, en caso de fracaso, puede repetirse esta técnica con tasas de éxito similares y sin mayor deterioro de la continencia[25].
Colgajo de avance sleeve (TSAF): Descrito por Berman en 1991, este procedimiento es empleado para fistulas perianales y rectovaginales complejas (especialmente en enfermedad de Crohn). Supone la elaboración de un colgajo con el 90-100% de la circunferencia del canal anal[20][26].
En el caso de los colgajos cutáneos, se emplea piel perianal para llevar a cabo la cobertura del orificio interno extirpado.
LIFT:
La técnica LIFT (ligadura del tracto en el espacio interesfintérico) fue inicialmente descrita en 2009 por Rojanasakul como una técnica sencilla y segura, con unas tasas de curación que podían llegar a alcanzar hasta el 94%[27],[28],[29].
Inicialmente fue empleada para fístulas transesfintéricas, si bien hoy en día se emplea en la mayoría de las fístulas, especialmente en complejas: recidivadas, multioperadas, rectovaginales y altas; parece ser especialmente interesante en las anteriores en mujeres y si existen alteraciones de la continencia (dado que el daño para ambos esfínteres está minimizado respecto a otras técnicas). La principal contraindicación es la presencia de abscesos o cavidades, en los que el trayecto fistuloso no está bien definido.
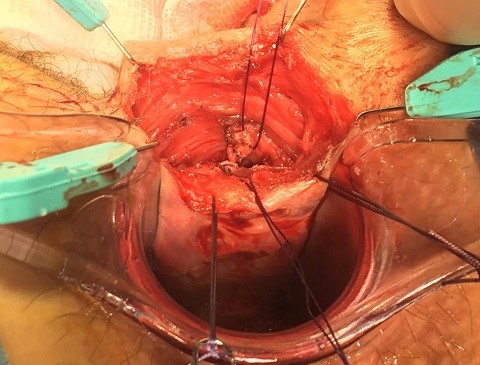
La técnica consiste en los siguientes pasos (ver imágenes 14-17)[28]:
- Identificación de orificio interno.
- Incisión en el espacio interesfintérico sobre el trayecto.
- Disección del mismo separando ambos esfínteres.
- Identificación del trayecto fistuloso.
- Ligadura y sección del trayecto a nivel del espacio interesfintérico, lo más próximo posible al orificio interno.
- Resección fistulosa en el citado espacio.
- Curetaje de cavidades y del trayecto hacia el orificio externo.
- Confirmación del sellado de la fístula con instilación de sustancias o sonda.
- Cierre de la herida perineal, generalmente con sutura absorbible.
Estos pasos pueden verse reflejados en un vídeo de técnica quirúrgica publicado recientemente por L. Cristóbal y cols[30].
En general presenta muy buenos resultados, si bien son necesarios más estudios prospectivos, comparativos y a largo plazo para confirmar estos hallazgos. Presenta una tasa de éxito entre el 40 y 95%, con mínimo porcentaje (6%) de incontinencia de tipo menor[31].
Posteriormente han aparecido modificaciones de la técnica original; en una de ellas (LIFT plus), se asocia una fistulectomía parcial[29] con tasas de curación del 83% y con mínima incontinencia asociada. En otras se ha reforzado la ligadura con una malla bioprotésica en el espacio interesfintérico[32] o instalando un tapón en el trayecto fistuloso (LIFT- PLUG), con excelentes resultados a largo plazo[33]. Igualmente se ha probado la técnica en pacientes a priori considerados como malos candidatos para ella como los pacientes con Crohn con resultados alentadores[34].
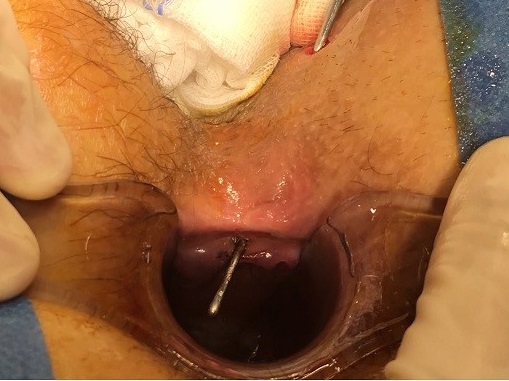 |
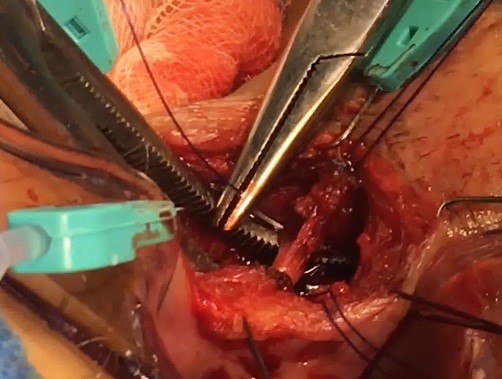 |
 |
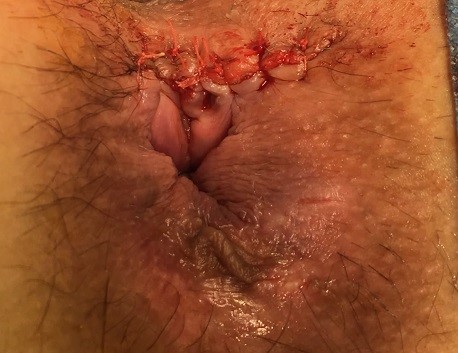 |
Imágenes 14-17: Técnica LIFT. 1) Tutorización del trayecto. 2) Disección y ligadura en espacio interesfintérico. 3) Sección en espacio interesfintérico. 4) Aspecto final.
VAAFT:
Este novedoso procedimiento video asistido (videoassisted fistula tract procedure) forma parte del arsenal terapéutico para las fístulas complejas, permitiendo la correcta identificación del orificio interno utilizando un fistuloscopio rígido bajo anestesia raquídea o general. Tras la introducción por el orificio externo, se instila suero en el trayecto, bajo visión directa, limpiando los focos abscesuales y localizando el orificio interno, que se cierra con un punto transfixivo. Utilizando el fistuloscopio se coagula todo el trayecto y finalmente, por vía rectal se introduce una endograpadora circular o lineal resecando el orificio fistuloso interno. Las tasas de cierre primario se sitúan en torno al 73% para las fístulas simples bajando en las complejas, si bien los elevados costos hacen que sea actualmente una técnica muy restringida y pendiente de validar sus resultados con más casuística y a largo plazo[35],[36].
Terapia celular:
Siguiendo la tendencia de los tratamientos mínimamente invasivos, se planteó el uso de procedimientos suplementados con células madre en este campo. Hemos de destacar que tanto la publicación pionera[37] como la mayor parte de la producción científica actual en este campo son de origen nacional.
Respecto a la terapia celular, fue inicialmente planteada para pacientes con Enfermedad de Crohn, en los que se administró a nivel submucoso y alrededor del tracto, o en su interior embebidas en adhesivo de fibrina (según el estudio), células madre autólogas derivadas de la grasa subcutánea (ASCs, Cx401), tras obtenerlas mediante liposucción. Primero se llevó a cabo un estudio en fase I en que se trataron 5 pacientes con Crohn y distintos tipos de fístulas (enterocutáneas, rectovaginales y perianales)[38]. Posteriormente, otro estudio en fase II solo en fístulas perianales en 35 pacientes con y 14 sin enfermedad de Crohn[39], ambos con resultados alentadores. Sin embargo, el ensayo prospectivo aleatorizado en fase III para fístulas perianales en pacientes sin Crohn no confirmó los resultados de los previos y solo se objetivaron diferencias significativas en los pacientes tratados en el centro pionero[40].
Posteriormente, se estudiaron también las células alogénicas (Cx601) focalizadas, sobre todo, en pacientes con Crohn. El ensayo en fase I/II demostró resultados alentadores[41] que en este caso si se han confirmado en un ensayo en fase III[42] (incluido su seguimiento a largo plazo)[43] y es posible que alcance la comercialización en fechas próximas.
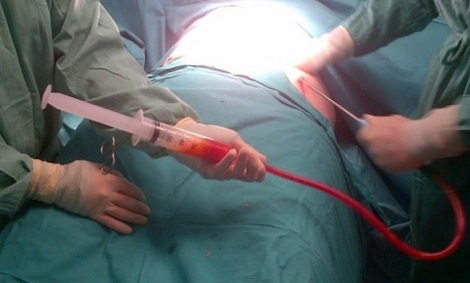
En los últimos trabajos del grupo del Dr. García Olmo, el procedimiento se ha simplificado a la vez que ha aumentado la dosis celular progresivamente. Actualmente se identifica el trayecto, se legra vigorosamente, se cierre de forma estanca el orificio interno y se añaden 120×106 ASCs alrededor del tracto, en él y alrededor del orificio interno[44] (ver imágenes 18-21).
 |
 |
Imágenes 18-19: lipoaspirado para obtención de células madre y procesado de grasa subcutánea.
 |
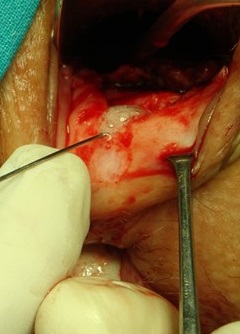 |
Imágenes 20-21: Preparado de células madre. Inyección a nivel submucoso.
En general, podemos afirmar que las tasas de curación se encuentran entre el 50 y el 64% con nula o mínima repercusión en la continencia[45],[46], y además son factibles los tratamientos iterativos en caso de falta o pérdida de respuesta al ser un tratamiento mínimamente invasivo y muy seguro. Aunque existen varios grupos internacionales realizando este tratamiento, en general a día de hoy, su uso se reserva a pacientes incluidos en ensayos clínicos o en protocolos de uso compasivo[47].
Otras técnicas y técnicas de obturación:
Se han descrito numerosas técnicas, con el fin de preservar la continencia anal al máximo, buscando conseguir altas tasas de cierre fistuloso y que, además, sean mínimamente invasivas. Las más populares son la instilación de pegamento de fibrina o la colocación de plugs o tapones en el orificio fistuloso interno y el tracto fistuloso.
Respecto al adhesivo de fibrina, se piensa que actúa estimulando el crecimiento de fibroblastos y el depósito de matriz extracelular en el tracto. Los resultados inicialmente alentadores parecen no haberse confirmado con el tiempo, estando en torno al 53% de curación con una amplia variación entre los estudios (10-78%)[48]. Además, parece decaer con el tiempo y no ha demostrado ventajas claras en curación o incontinencia con respecto al tratamiento quirúrgico convencional[49].
De los plug o tapones, destacan la submucosa porcina, Gore® BioA® (mallas de ácido poliglicólico y carbonato trimetileno, Gore®, Arizona, EEUU) y Permacoll™ (colágeno dérmico porcino –Medtronic, Minneapolis, EEUU-). Resultados: suelen estar en torno al 50% de curaciones con escasa afectación de la continencia, siendo similares a los colgajos de avance a corto plazo, pero inferiores a largo plazo[50],[51].
Los resultados en la literatura de todas estas técnicas son variables; en general, presentan bajas tasas de incontinencia postoperatoria con tasas de cierre discordantes según los diferentes estudios, pero en torno al 50%. La metodología de uso también varía entre los autores, pues algunos las emplean de forma aislada y otros combinadas con curetajes u otras técnicas. Habrá que esperar a los resultados de los estudios en curso para extraer conclusiones claras al respecto.
En este mismo bloque podría incluirse el tratamiento con láser del tracto (FiLaC) que busca obliterarlo destruyendo el epitelio con un láser; se describió de forma combinada con un colgajo de avance[52] y posteriormente se ha usado de forma aislada[53]. Está pendiente de la validación de sus resultados por el uso a largo plazo y comparándolo con otras técnicas.
Discusión:
El tratamiento de los pacientes con fístulas perianales, especialmente aquellas complejas o recidivadas, continúa siendo un auténtico quebradero incluso para cirujanos coloproctólogos experimentados. Las numerosas técnicas descritas (ninguna perfecta ni exenta de riesgos, como hemos visto) y la amplia variabilidad en los resultados publicados nos llevan a pensar que no existe un tratamiento estándar. Por el contrario, deberemos adaptarnos no solo a las características del paciente, sino principalmente a las de la fístula, siendo especialmente relevante la relación de la misma con el aparato esfinteriano. Por tanto, es fundamental caracterizar las fístulas de forma apropiada. Hay que considerar también su continencia, las expectativas del paciente ante la cirugía y la experiencia del equipo que lo trata. Una buena operación mal indicada o ejecutada puede tener fatales consecuencias. Es fundamental planificar la cirugía y plantear de forma detallada todas las opciones disponibles a los pacientes para la toma de decisiones.
Por estos motivos, podemos afirmar que el cirujano colorrectal debe conocer y dominar todas o la mayoría de las técnicas y aplicarlas de forma individualizada a cada paciente adecuado, para así obtener los mejores resultados.
Para fistulas perianales simples, bajas, no recidivadas y de trayecto único y que afectan menos del 30% del aparato esfinteriano, podemos realizar una fistulotomía o puesta a plano, o incluso una fistulectomía, con la seguridad de no afectar la continencia anal, especialmente en pacientes varones jóvenes.
Los pacientes con fístulas altas, recidivadas, rectovaginales o con enfermedad de Crohn deben ser tratados por cirujanos colorrectales con experiencia, pudiendo precisar cirugías escalonadas. En estos pacientes se puede realizar, generalmente con seguridad, un flap mucoso rectal o el procedimiento de LIFT. Algunos autores emplean con buenos resultados también los sedales cortantes.
En casos de sepsis o abscesos perianales es preferible realizar una cirugía en dos tiempos, controlando inicialmente la infección y colocando un setón laxo, para posteriormente realizar la técnica que corresponda según la anatomía de la fístula.
Las diferentes técnicas pueden asociarse entre sí, así como a la terapia celular, con una probable implementación de los resultados.
Conclusiones:
Las fístulas perianales pueden clasificarse en simples o complejas.
En función del paciente y sus características, la presencia de abscesos o las características de la fistula, emplearemos una u otra técnica quirúrgica.
Para fístulas simples (bajas, no recidivadas y de trayecto único) puede realizarse fistulectomía o fistulotomía, mientras que para fístulas complejas (altas, multioperadas, rectovaginales o asociadas a enfermedad de Crohn), estaría indicada en general la realización de un flap o un LIFT.
El uso de setones es de gran utilidad en pacientes que asocian absceso o cavidades perianales, pudiendo emplearse como tratamiento definitivo o como puente a otra cirugía.
En todos los casos, el objetivo buscado es la curación de la fístula preservando la función esfintérica.
Declaraciones y conflicto de intereses: Jacobo Trébol López, coautor de este artículo, es Editor de la Revista ACIRCAL. El manuscrito ha sido evaluado por otros miembros de los Comités Editorial y Científico. No existen otros conflictos de interés.
Referencias bibliográficas:
[1] Zanotti C, Martinez-Puente C, Pascual I, Pascual M, Herreros D, García-Olmo D. An assessment of the incidence of fistula-in-ano in four countries of the European Union. Int J Colorectal Dis. 2007 Dec;22(12):1459-62.
[2] Parks AG, Gordon PH, Hardcastle JE. A classification of fistula-in-ano. Br J Surg 1976; 63:1–12.
[3] Cirocco WC, Reilly JC. Challenging the predictive accuracy of Goodsall’s rule for anal fistulas. Dis Colon Rectum 1992; 35:537–542.
[4] A E Delgado, L Correa; M Werenitzky; H Baistrocchi. “Ley de Goodsall”, ¿Mito o Realidad? Rev argent coloproct. 2013. Vol. 24, Nº 4: 176-180
[5] Ruiz-Tovar J, Sánchez Picot S, Alonso Hernández N, Díez Nicolás V. Pneumoretroperitoneum secondary to surgical lavage of a perianal abscess with hydrogen peroxide. Cir Esp. 2006 Aug; 80 (2):115.
[6] Tsai SK, Lee TY, Mok MS. Gas embolism produced by hydrogen peroxide irrigation of an anal fistula during anesthesia. Anesthesiology. 1985 Sep; 63 (3):316-7.
[7] Tabry H, Farrands PA. Update on anal fistulae: Surgical perspectives for the gastroenterologist. Can J Gastroenterol 2011; 25(12): 675-680.
[8] Viso Pons L. Primeras citas de una Historia. La proctología en el antiguo Egipto. Rev Esp Enf Dig. 1991; 79 (3): 227 – 231.
[9] Viso Pons L. Análisis de una herencia básica. Hipócrates y la Proctología. Re Esp Enf Dig. 1992; 80 (5): 348 – 351.
[10] Pascual Miguelañez I., Alvarez Gallego M., Rubio Perez I., Funes Dueñas T., Gazo Martinez J. A. Adapting fistula surgery to fistula tract and patient condition: towards a tailored treatment. Eur Surg (2016) 48:4–11
[11] Vial M, Parés D, Pera M, Grande L. Faecal incontinence after seton treatment for anal fistulae with and without surgical division of internal anal sphincter: a systematic review. Colorectal Dis. 2010;12:172–8. doi:10.1111/j.1463–1318.2009.01810.x.
[12] Subhas G, Gupta A, Balaraman S, Mittal VK, Pearlman R. Non-cutting setons for progressive migration of complex fistula tracts: a new spin on an old technique. Int J Colorectal Dis. 2011 Jun;26(6):793-8. doi: 10.1007/s00384-011-1189-5. Epub 2011 Mar 23.
[13] Ritchie RD, Sackier JM, Hodde JP. Incontinence rates after cutting seton treatment for anal fistula. Colorectal Dis 2009;11: 564-71
[14] B Hamza Shirah, H Asaad Shirah. The Impact of the Outcome of Treating a High Anal Fistula by Using a Cutting Seton and Staged Fistulotomy on Saudi Arabian Patients. Ann Coloproctol 2018;34(5):234-240.
[15] Rakinic J. Benign Anorectal Surgery. Management. Advances in Surgery 52 (2018) 179–204.
[16] Izadpanah A, Rezazadehkermani M, Hosseiniasl SM, Farghadin A, Ghahramani L, Bananzadeh A, Roshanravan R, Izadpanah A. Pulling Seton: Combination of mechanisms. Adv Biomed Res. 2016 Apr 19;5:68.
[17] Williams G, Williams A, Tozer P, Phillips R, Ahmad A, Jayne D, Maxwell-Armstrong C. The treatment of anal fistula: second ACPGBI Position Statement – 2018. Colorectal Dis. 2018 Jul; 20 Suppl 3: 5-31. doi: 10.1111/codi.14054.
[18] Sjodahl R. Proposal: a score to select patients for fistulotomy. Colorectal Dis. 2010;12:487–9. doi:10.1111/j.1463-1318.2009.02106.x.
[19] Garg P. Is fistulotomy still the gold standard in present era and is it highly underutilized?: An audit of 675 operated cases. Int J Surg. 2018 Aug; 56: 26-30. doi: 10.1016/j.ijsu.2018.06.009. Epub 2018 Jun 8.
[20] F. J. Pérez Lara et al. Fístula perianal de origen criptoglandular: ¿qué hay de nuevo? Cir. Andal. 2013; 24; 39-45.
[21] Whiteford MH. Perianal Abscess/Fistula Disease. Clin Colon Rectal Surg 2007; 20: 102–10.
[22] Ortíz H, Marzo J. Endorectal flap advancement repair and fistulectomy for high trans-sphincteric and suprasphincteric fistulas. Br J Surg. 2000; 87:1680–3.
[23] Uribe N, Millán M, Minguez M, Ballester C, Asencio F, Sanchiz V, et al. Clinical and manometric results of endorectal advancement flaps for complex anal fistula. Int J Colorectal Dis. 2007;22:259–64.
[24] Garcia-Aguilar J, Belmonte C, Wong WD, Goldberg SM, Madoff RD. Anal fistula surgery. Factors associated with recurrence and incontinence. Dis Colon Rectum. 1996;39:723–9.
[25] Mitalas LE, Gosselink MP, Zimmerman DD, Schouten WR. Repeat transanal advancement flap repair: impact on the overall healing rate of high transsphincteric fistulas and on fecal continence. Dis Colon Rectum. 2007;50:1508–11. doi:10.1007/DCR.0b013e3181a7b61e.
[26] Valente MA, Hull TL. Contemporary surgical management of rectovaginal fistula in Crohn’s disease. World J Gastrointest Pathophysiol. 2014 Nov 15;5(4):487-95.
[27] A. Rojanasakul, J. Pattanaarun, and C. Sahakitrungruang. Total anal sphincter saving technique for fistula-in-ano; The ligation of 12 intersphincteric fistula tract. Journal of the Medical Association of Thailand, vol. 90,no. 3, pp. 581–586, 2007.
[28] Siripong Sirikurnpiboon, Burin Awapittaya, Paiboon Jivapaisarnpong. Ligation of intersphincteric fistula tract and its modification:Results from treatment of complex fistula. World J Gastrointest Surg 2013 April 27; 5(4): 123-128. ISSN 1948-9366.
[29] Sun XL, Wen K, Chen YH, Xu ZZ, Wang XP. Long-term outcomes and quality of life following ligation of the intersphincteric fistula tract for high transsphincteric fistulas. Colorectal Dis. 2018 Sep 5. doi: 10.1111/codi.14405.
[30] Lidia Cristóbal, Sonia Castanedo, Isabel Seco, Marcos Gómez, José Ignacio Martín, Joaquín Alonso, Manuel Gómez, Julio Del Castillo. Ligadura interesfinteriana del trayecto fistuloso (lift): nuestra técnica de elección para el tratamiento quirúrgico de fístulas transesfinterianas anteriores. Rev Acircal. 2019; 6 (1): 77-83.
[31] Yassin NA, Hammond TM, Lunniss PJ, Phillips RK. Ligation of the intersphincteric fistula tract in the management of anal fistula. A systematic review. Colorectal Dis. 2013;15:527–35. doi:10.1111/codi.12224.
[32] Ellis CN. Outcomes with the use of bioprosthetic grafts to reinforce the ligation of the intersphincteric fistula tract (BioLIFT procedure) for the management of complex anal fistulas. Dis Colon Rectum. 2010 Oct; 53 (10): 1361-4. doi: 10.1007/DCR.0b013e3181ec4470.
[33] Han JG, Yi BQ, Wang ZJ, Zheng Y, Cui JJ, Yu ZQ, et al. LIFT plus a bioprosthetic anal fistula plug (LIFT-Plug): a new technique for fistula-in-ano. Colorectal Dis. 2013;15:582-6.
[34] Gingold DS, Murrell ZA, Fleshner PR. A prospective evaluation of the ligation of the intersphincteric tract procedure for complex anal fistula in patients with Crohn’s disease. Ann Surg. 2014;260:1057–61. doi:10.1097/SLA.0000000000000479.
[35] Meinero P, Mori L. Video-assisted anal fistula treatment (VAAFT): a novel sphincter-saving procedure for treating complex anal fistulas. Tech Coloproctol. 2011 Dec;15(4):417-22
[36] Romaniszyn M, Walega P.Video-Assisted Anal Fistula Treatment: Pros and Cons of This Minimally Invasive Method for Treatment of Perianal Fistulas.Gastroenterol Res Pract. 2017;2017: 9518310.
[37] García-Olmo D, García-Arranz M, Gómez-García L et al. Autologous stem-cell transplantation for treatment of recto-vaginal fistula in perianal Crohn’s disease: a new cell based therapy. Int J Colorectal Dis 2003;18:451-454.
[38] García-Olmo D et al. A phase I clinical trial of the treatment of Crohn’s fistula by adipose mesenchymal stem cell transplantation. Dis. Colon and Rectum 2005; 48:1416-1423.
[39] Garcia-Olmo, D. et al., Expanded Adipose-Derived Stem Cells for the Treatment of Complex Perianal Fistula: a Phase II Clinical Trial. Diseases of the Colon & Rectum, 2009. 52(1): p. 79-86
[40] Herreros MD, Garcia-Arranz M, Guadalajara H, De-La-Quintana P, Garcia-Olmo D; FATT Collaborative Group. Autologous expanded adipose-derived stem cells for the treatment of complex cryptoglandular perianal fistulas: a phase III randomized clinical trial (FATT 1: fistula Advanced Therapy Trial 1) and long-term evaluation. Dis Colon Rectum. 2012 Jul; 55 (7): 762-72. doi: 10.1097/DCR.0b013e318255364a.
[41] de la Portilla F, Alba F, García-Olmo D, Herrerías JM, González FX, Galindo A. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn’s disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis. 2013 Mar;28(3):313-23. doi: 10.1007/s00384-012-1581-9.
[42] Panés J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet. 2016 Sep 24;388(10051):1281-90. doi: 10.1016/S0140-6736(16)31203-X.
[43] Panés J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, et al; ADMIRE CD Study Group Collaborators. Long-term Efficacy and Safety of Stem Cell Therapy (Cx601) for Complex Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology. 2018 Apr;154(5):1334-1342.e4. doi: 10.1053/j.gastro.2017.12.020.
[44] Georgiev-Hristov T, Guadalajara H, Herreros MD, Lightner AL, Dozois EJ, García-Arranz M, García-Olmo D. A Step-By-Step Surgical Protocol for the Treatment of Perianal Fistula with Adipose-Derived Mesenchymal Stem Cells. J Gastrointest Surg. 2018 Nov;22(11):2003-2012. doi: 10.1007/s11605-018-3895-6.
[45] F E Dailey, EP Turse, Ma Naseer, J D Bragg, V Tahan. Review of stem cells as promising therapy for perianal disease in inflammatory bowel disease. World J Transplant 2018 August 9; 8(4): 97-101
[46] Choi S, Jeon BG, Chae G, Lee SJ. The clinical efficacy of stem cell therapy for complex perianal fistulas: A meta-analysis. Techniques in Coloproctology. May 2019, volume 23, Issue 5, pp411-427.
[47] Herreros MD, Garcia-Olmo D, Guadalajara H, Georgiev-Hristov T, Brandariz L, Garcia-Arranz M. Stem Cell Therapy: A Compassionate Use Program in Perianal Fistula. Stem Cells Int. 2019 May 5; 2019: 6132340. doi: 10.1155/2019/6132340.
[48] Swinscoe MT, Ventakasubramaniam AK, Jayne DG. Fibrin glue for fistula-in-ano: the evidence reviewed. Tech Coloproctol. 2005;9:89–94.
[49] Cirocchi R, Santoro A, Trastulli S, Farinella E, Di Rocco G, Vendettuali D, et al. Meta-analysis of fibrin glue versus surgery for treatment of fistula-in-ano. Ann Ital Chir. 2010 Sep-Oct; 81 (5): 349-56.
[50] Lin H, Jin Z, Zhu Y, Diao M, Hu W. Anal fistula plug vs rectal advancement flap for the treatment of complex cryptoglandular anal fistulas: a systematic review and meta-analysis of studies with long-term follow-up. Colorectal Dis. 2019 May;21(5):502-515. doi: 10.1111/codi.14504.
[51] Giordano P, Sileri P, Buntzen S, Stuto A, Nunoo-Mensah J, Lenisa L et al. Final results of a European, multi-centre, prospective, observational Study of Permacol™collagen paste injection for the treatment of anal fistula. Colorectal Dis. 2017 May 11. doi: 10.1111/codi.13715.
[52] Wilhelm A. A new technique for sphincter-preserving anal fistula repair using a novel radial emitting laser probe. Tech Coloproctol. 2011;15:445–9. doi:10.1007/s10151-011-0726-0.
[53] Giamundo P, Esercizio L, Geraci M, Tibaldi L, Valente M. Fistula-tract Laser Closure (FiLaC™): long-term results and new operative strategies. Tech Coloproctol 2015;19:449–53.
